急性経過の末梢神経障害を呈する代表的な疾患です。先行感染・蛋白細胞解離・神経伝導検査異常などがあれば典型的ですが、先行感染が明確ではない例もあり、髄液検査・神経伝導検査は発症早期には異常を呈さないことが多いです。臨床病型が多彩であること、特異的なバイオマーカーがないことも含めて、発症早期の明確な診断は難しいことが多いですが、重症例では早期の治療介入が必要であるため、managementに苦慮します。病歴と診察所見(腱反射の消失)の丁寧かつ早急な確認が重要です。
重症度評価・治療については別記事でまとめました。
概説
急性に発症する左右対称性・弛緩性の運動麻痺と腱反射減弱・消失がみられる。発症前の4週間以内に感染症などの先行イベントを伴う。経過は単相性であり、発症から4週間以内にピークに達し、ピークを過ぎると改善へと向かう。呼吸障害や心血管系自律神経障害によって致命的となりうる。
病因
概要
感染症などの先行イベントが、末梢神経を標的とする免疫応答を惹起することによって発症すると考えられている。
約60%の症例でヒト末梢神経に存在する様々な糖脂質に対する自己抗体が検出される。
Campylobacter jejuniやMycoplasma pneumoniaeなどの病原体は、膜上に末梢神経構成成分と分子相同性を有する糖鎖を発現しており、感染によってこれらに対する抗体産生が起こると考えられている。
また神経傷害部位において、補体活性化が起こることで細胞膜が破壊されることも示唆されている。
C.jejuni感染者1,000人あたりGBSは1人程の頻度でしか発症しないため、宿主側の免疫遺伝学的背景も関連していると考えられている。
脱髄
AIDP(acute inflammatory demyelinating polyneuropathy)
ミエリンを形成するシュワン細胞における局所の炎症による脱髄。
T細胞・マクロファージの浸潤や補体の活性化がみられる。
脱髄はblood-nerve barrierが欠損している神経根から始まる。
blood-nerve barrierの破綻によって、血液中の蛋白質が脳脊髄液内へと漏出する。
炎症の強さに応じて、二次性の軸索変性が生じることがある。
軸索障害
AMAN(acute motor axonal neuropathy)・AMSAN(acute motor sensory axonal neuropathy)
USでは比較的まれであるが、アジアではより頻度が高い。
T細胞浸潤や脱髄を伴わず、一次的に軸索障害が起こる。
IgGの沈着や補体の活性化が軸索のnode・internodeにみられる(抗体・補体介在性液性免疫)。
マクロファージが軸索とミエリンの間のperiaxonal spaceに浸潤し、paranodal myelinを離開させることでnodeが延長するため、神経伝導が遅延する。
GM1ガングリオシドで自己免疫したウサギで、抗GM1抗体によってAMANに似た病態を引き起こす。
*node・internode・periaxonal spaceについて。
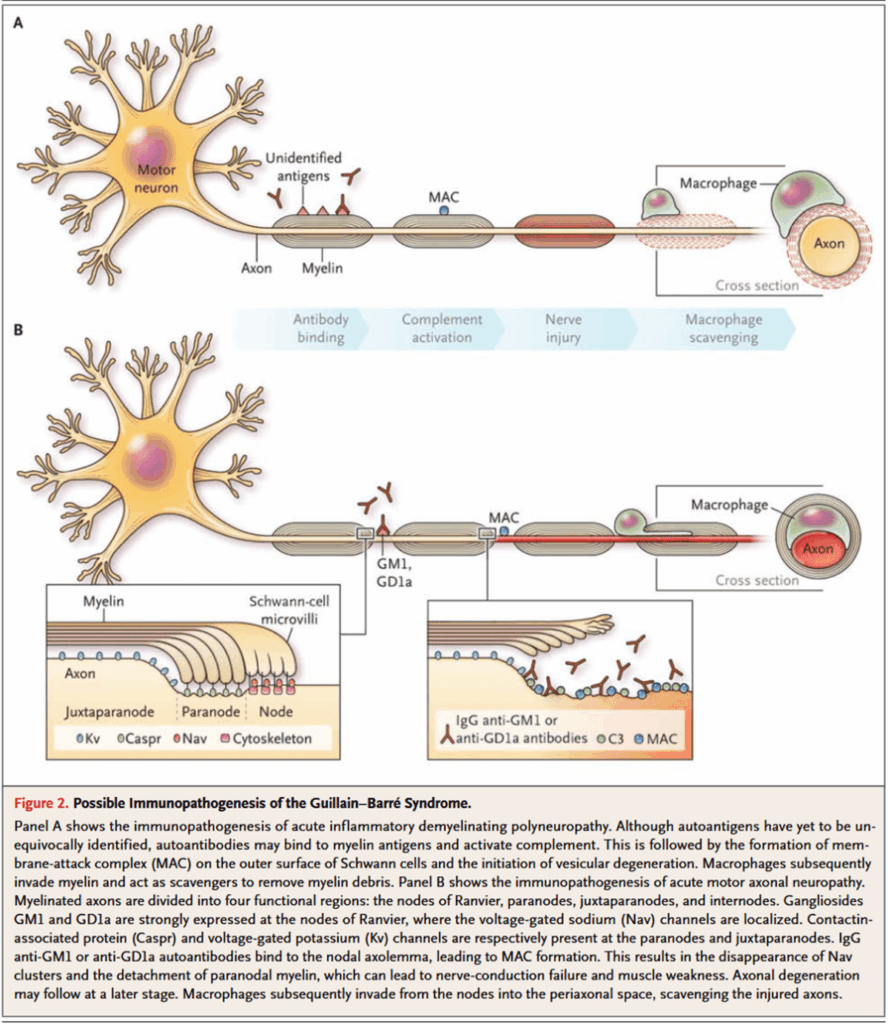
*N Engl J Med. 2012;366(24):2294-304.
AIDPとAMANの違い
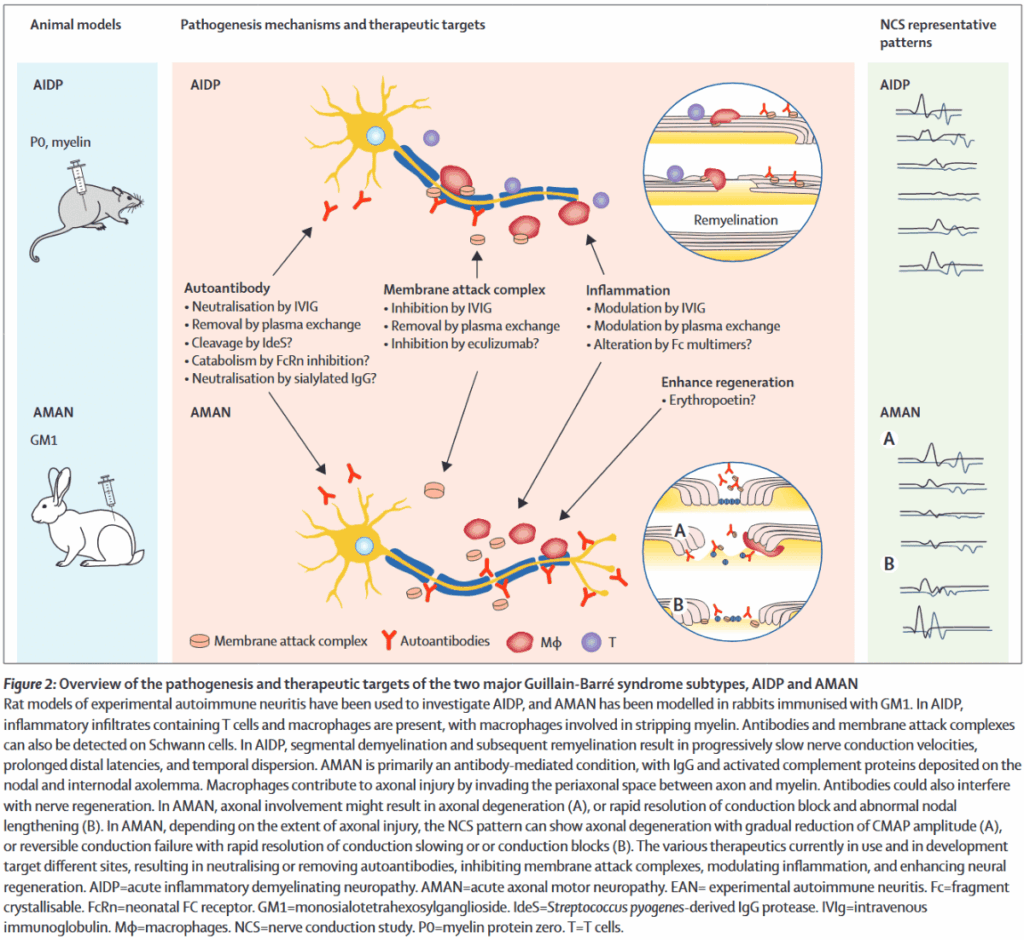
*Lancet. 2021;397(10280):1214-1228.
- AIDP
-
回復過程は、再髄鞘化と二次的軸索変性の程度による。
再髄鞘化には数週間から数か月を要する。
軸索変性が高度であれば、回復はさらに遅れ、不完全になる。
- AMAN
-
回復過程は、軸索変性の程度による。
抗体の接着によって軸索再生が阻害される。
reversible conduction failure:最初のFigureの(B)のパターン
- 自己抗体介在性の伝導遅延・伝導ブロックがみられることがある。
- 伝導速度は軽度の低下にとどまる。
- 病状・伝導障害が早期に回復することが多い。
疫学
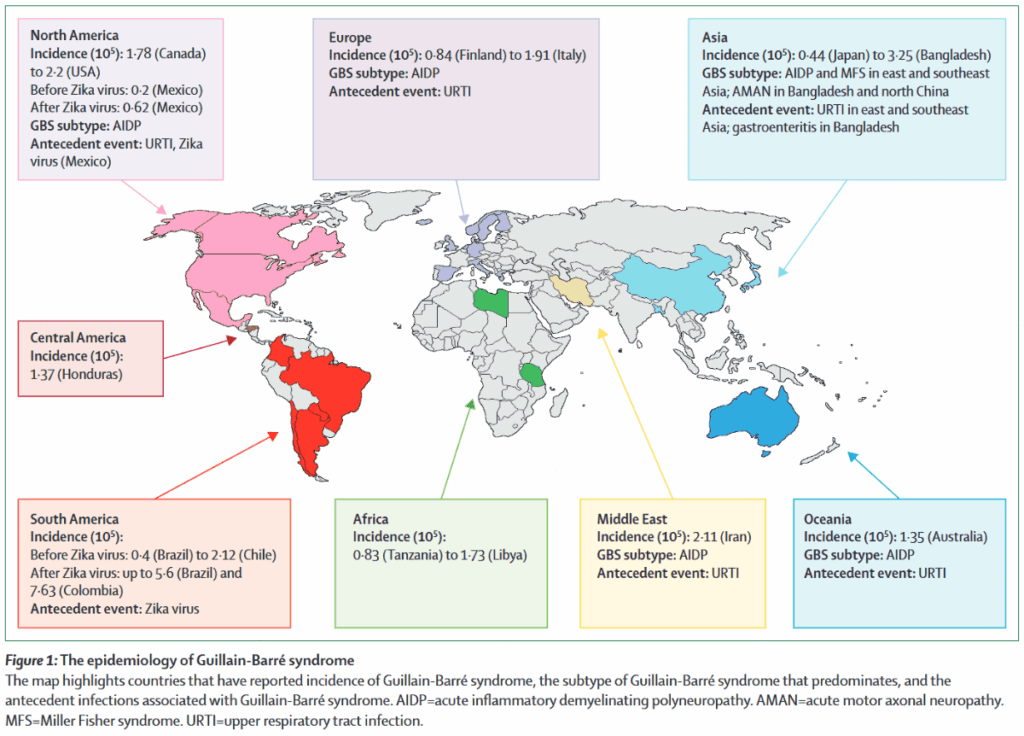
*Lancet. 2021;397(10280):1214-1228.
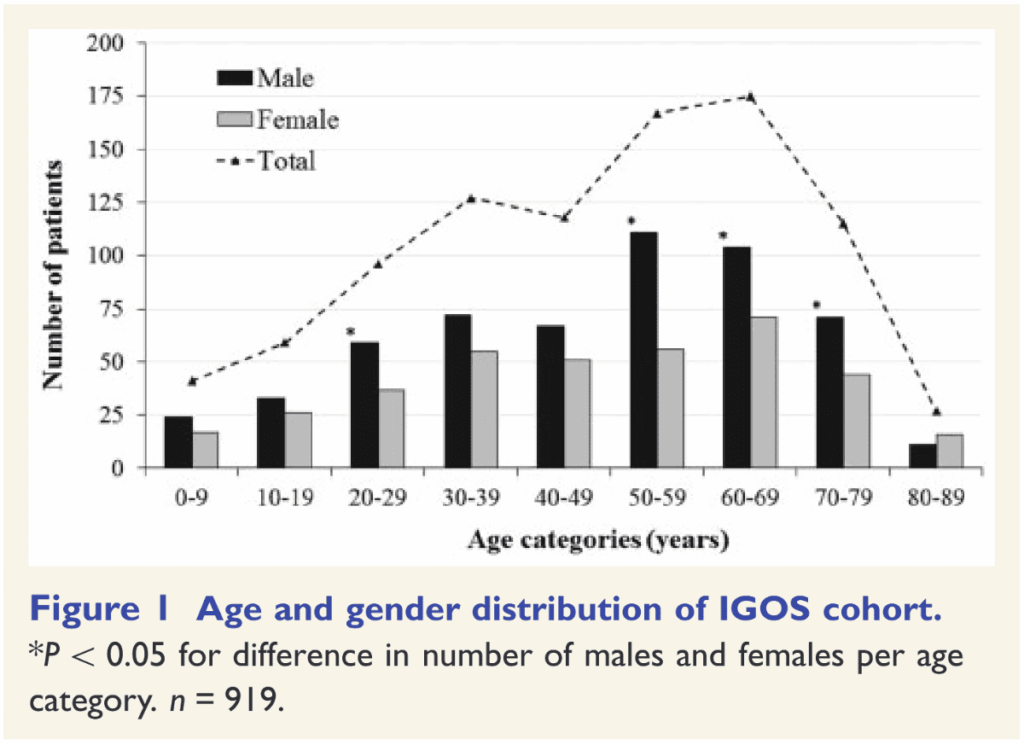
*Brain. 2018;141(10):2866-2877.
年間発症率は0.81-1.91/10万人程度。
男女比は1.78:1。
臨床病型
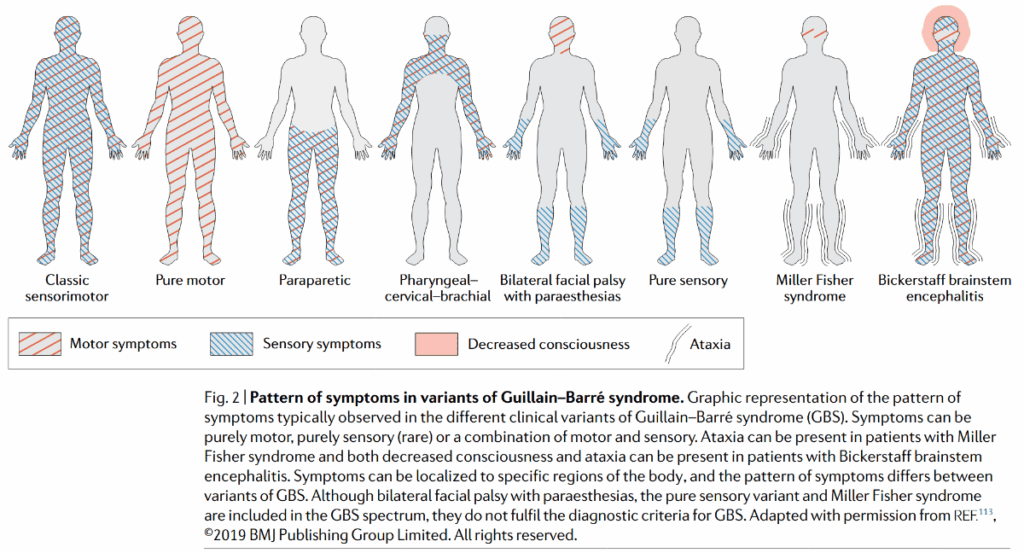
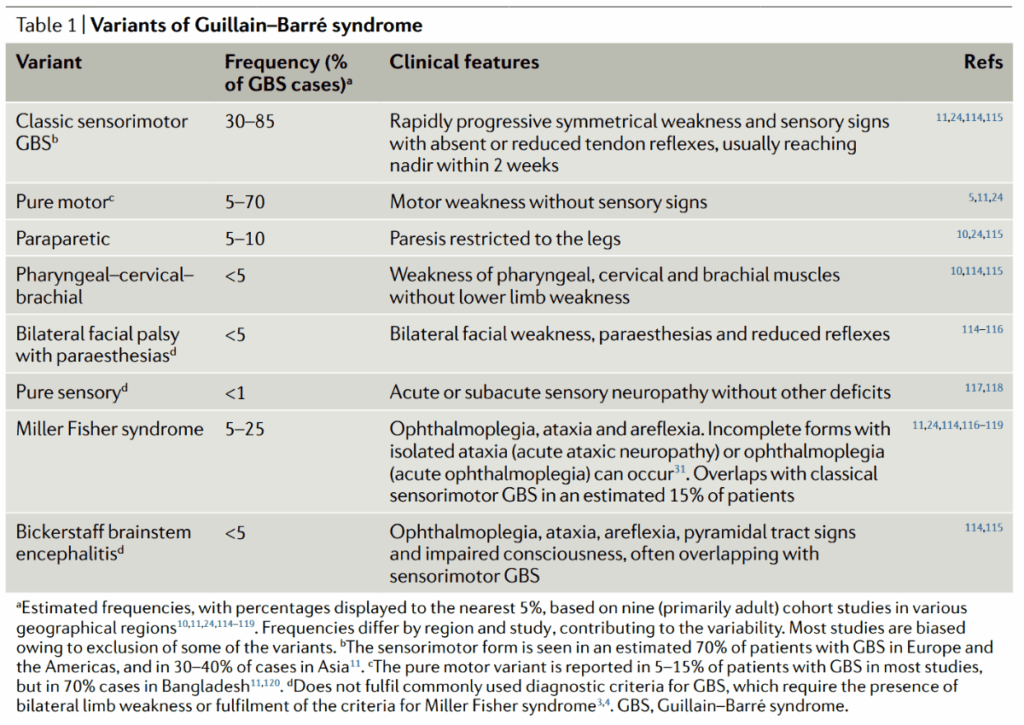
*Nat Rev Neurol. 2019;15(11):671-683.
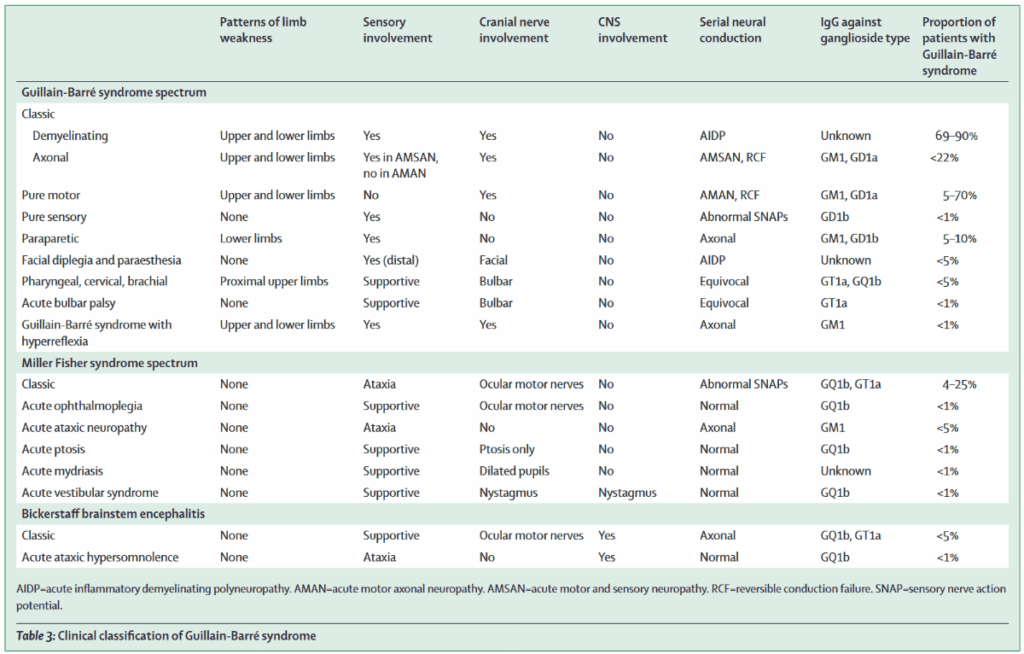
*Lancet. 2021;397(10280):1214-1228.
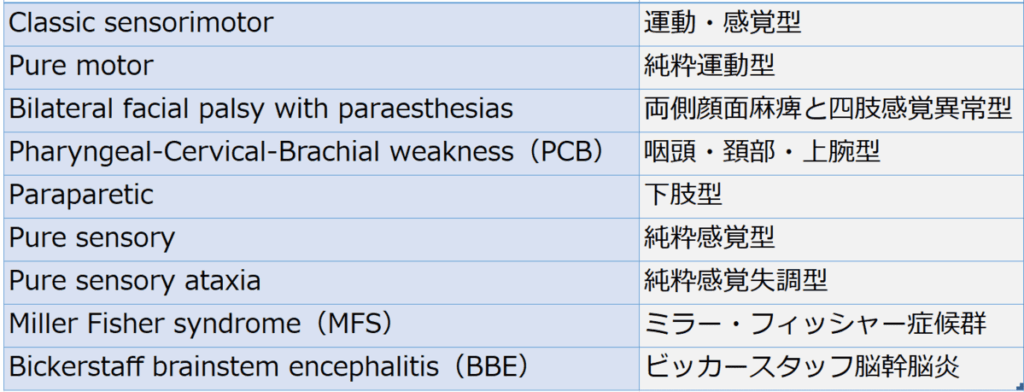
*純粋に上記の病型に当てはまることはまれであり、部分的にオーバーラップすることが多い。
先行イベント
感染症
- 疫学
-
本邦の全国調査:先行感染は上気道感染が70%で春冬に多く、次いで消化器感染が20.6%で春夏に多い。
International GBS Outcome Study(IGOS):76%で先行イベントがみられた。そのうち、35%は上気道感染、27%は消化器感染であった。
- Campylobacter jejuni
-
GBS症例の約25%で特定される。
- AMAN・AMSANの約60-70%。
- AIDPの30%程度。
運動優位の軸索型(AMAN)を発症し、感覚障害がない(純粋運動型)ことが多い。
MFSを発症することもある。
他の先行イベント例と比較して、予後不良・回復が遅い・神経学的後遺症の残存率が高い。
- CMV
-
脱髄をきたすことが多い。
感覚障害が高度である例が報告されている。
四肢麻痺・呼吸障害を生じる重度の運動障害を呈した例の報告あり。
運動感覚型が94%・純粋運動型が6%との報告あり。
- その他
-
ジカウイルス・COVID-19:AIDPが多い。
他に,Haemophilus influenzae・Mycoplasma pneumoniae・HEV・インフルエンザウイルスなどの報告あり。
ワクチン
一部のワクチン(遺伝子組み換え帯状疱疹ワクチン・SARS-CoV-2アデノウイルスベクターワクチン)接種によってわずかにGBSリスクが上昇したとの報告がある。
ほとんどのワクチン接種とGBS発症リスク増加の関連性は証明されていない。
その他
手術・外傷・骨髄移植などで報告あり。
薬剤:TNF-α阻害薬・タクロリムス・イソトレチノイン・免疫チェックポイント阻害薬
神経症候
- 四肢筋力低下
-
左右対称性。
下肢から始まり、上肢へと進展する。
遠位筋・近位筋のいずれもが障害されうる。
非典型例:左右非対称・上肢筋から始まる、など。
- 腱反射
-
初診時には90%、症状ピーク時にはほとんどの例で、腱反射は減弱・消失する。
臨床病型のpure motor variantや、電気生理学的分類のAMANでは、腱反射が正常または亢進していることがある。
- 感覚障害
-
手足のしびれ感が麻痺症状に先行することが多い。
運動障害と比べて軽度であり、異常感覚のみであることが多い。
感覚脱失や疼痛に至ることもある。
- 脳神経障害
-
顔面神経麻痺・咽頭筋麻痺・眼球運動障害など。
- 呼吸障害
-
人工呼吸器装着リスクについては、
- 自律神経障害
-
38%の患者でみられるとの報告あり。
心血管系:血圧高値・血圧低値・頻脈・徐脈。
他に、麻痺性イレウス・排尿障害・瞳孔異常・発汗異常など。
自律神経障害を伴う例では、ICU入室率・人工呼吸器装着率・死亡率が高いと報告あり。
臨床経過
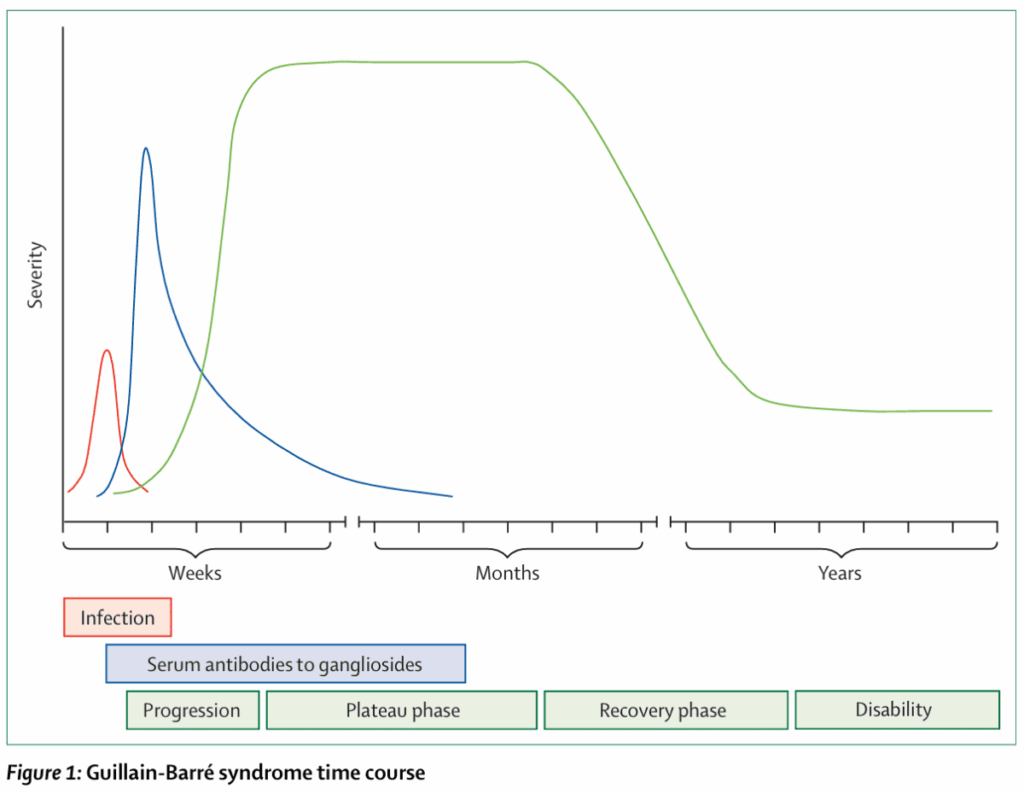
*Lancet. 2016;388(10045):717-27.
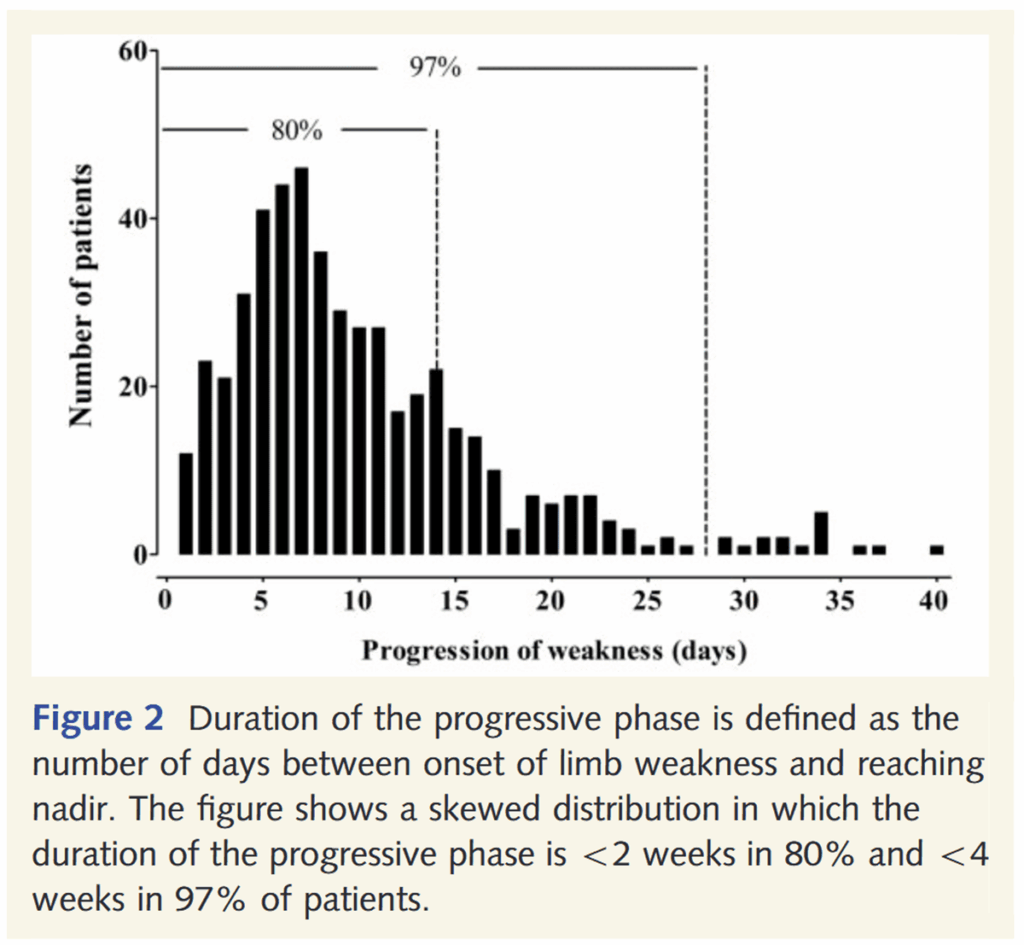
*Brain. 2014;137(Pt 1):33-43.
発症後4週間以内に症状のピークとなり、単相性の経過をとる。
症状のピークが発症後4-6週となるのは3%に過ぎない。
発症から症状のピークまで、24時間以内または4週間以上であれば、他疾患を考慮する。
治療開始8週以内に治療関連変動(FGまたはMRC sum scoreの1以上の低下)が16%で起こる。
症状の進行が8週を超える場合はCIDPを考慮する。
臨床的特徴のまとめ

*Brain. 2018;141(10):2866-2877.
検査
典型例では臨床経過と診察所見に基づいて診断をする。
非典型例などにおいて、診断精度を高めるため・他疾患を除外するために補助検査を実施する。
血液検査
他疾患との鑑別
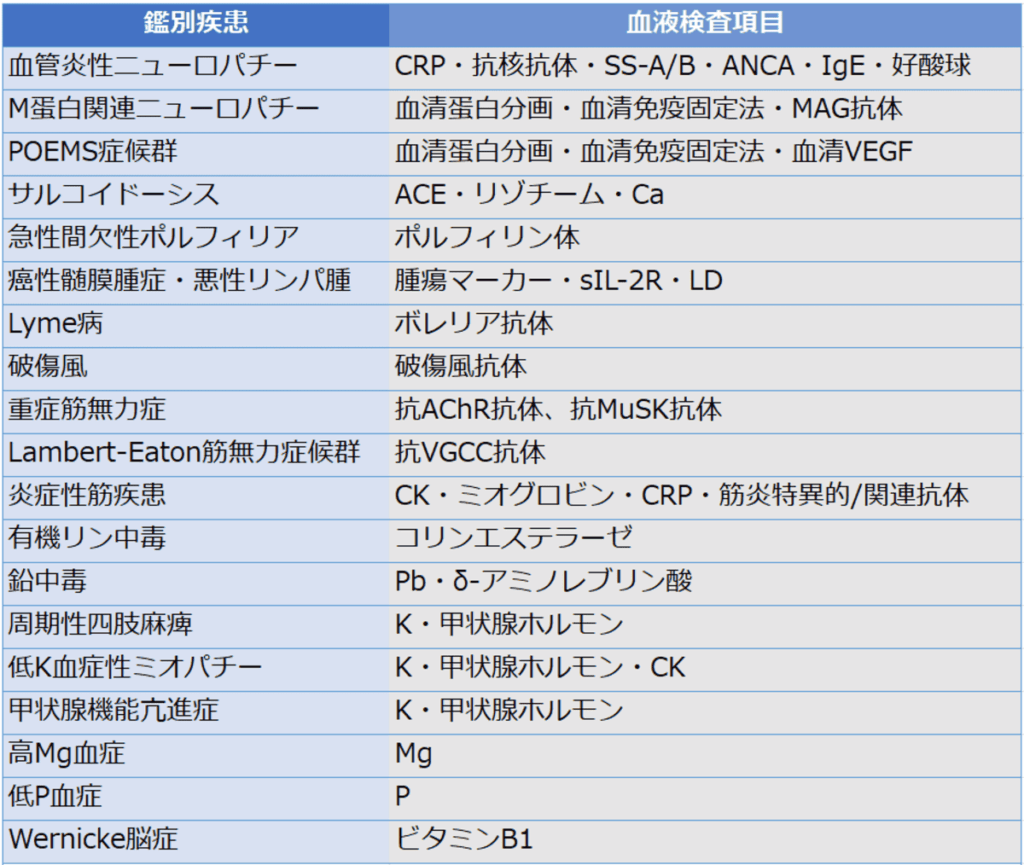
先行感染:C.jejuni・EBV・CMV・Mycoplasma pneumoniae
下痢を先行症状とする場合は、便培養によるC.jejuni検出を考慮する。
脳脊髄液検査
GBSでの典型的な所見として、蛋白高値・細胞数正常(蛋白細胞乖離)がある。しかし、髄液蛋白は発症早期には正常であることがある。
明らかな細胞数上昇(>50/μL):他疾患を示唆する。
軽度の細胞数上昇(10-50/μL):GBSも否定しきれないが、他疾患の可能性が高い。
IgG index:約30%の症例で上昇の報告あり。
オリゴクローナルバンドの検出はない。
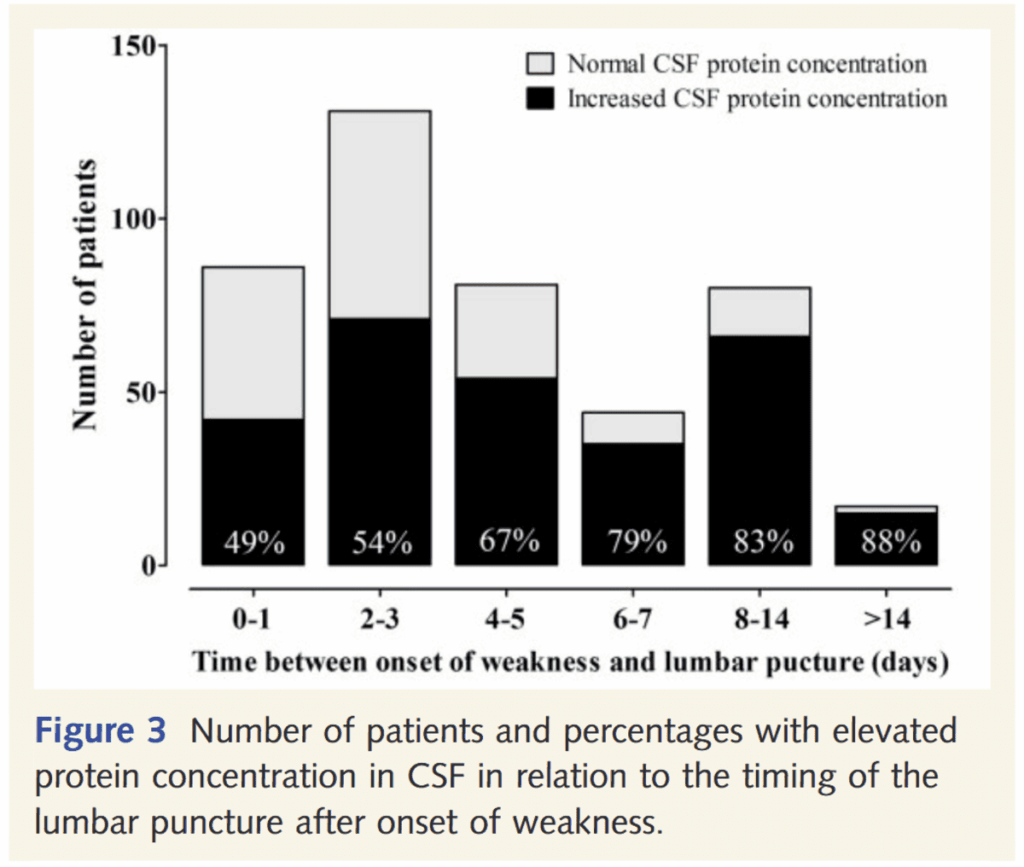
*Brain. 2014;137(Pt 1):33-43.
神経伝導検査
- 病初期の異常
-
H波・F波の消失、A波の出現
- 脱髄
-
F波潜時の延長・遠位潜時延長・伝導ブロック・時間的分散・神経伝導速度の低下
- 軸索障害
-
運動・感覚神経の振幅低下
- sural sparing pattern(abnormal median and normal sural sensory responses:AMNS)
-
感覚神経伝導検査で、正中・尺骨神経が障害され、腓腹神経が相対的に保たれる所見。
正中・尺骨神経のSNAPは神経終末で記録されるのに対して、腓腹神経のSNAPは神経終末から20cmほど近位部で記録されるため、感覚神経の初期病変が神経終末にあることを示す。
GBS(特にAIDP)に特徴的である。
- 時間的推移
-
病初期(特に発症から1週間以内)や、近位部優位の脱力・軽症例・進行が緩徐な例などでは、異常所見が得られないことがある。
その場合は、2-3週間後にかけて検査を繰り返すことが有用である。
抗糖脂質抗体
急性期に、スフィンゴ糖脂質であるガングリオシドや中性糖脂質であるガラクトセレブロシドに対する抗体が血清中に検出され、陽性率は60%程度とされる。
- 抗体の種類
-
先行感染の病原体や臨床像と関連することが多い。
特にIgG型糖脂質抗体が病的意義を持ち、IgGのサブクラスは補体活性作用を持つIgG1・IgG3である。
IgM型糖脂質抗体は先行感染を反映するのみで、神経障害とは直接関係しないと考えられている。
以下の報告あり。
- 神経障害のないカンピロバクター腸炎患者の27%でIgM型GalNAc-GD1a抗体が陽性。
- 神経障害のないマイコプラズマ感染症患者で高率にIgM型galactocerebroside抗体が陽性。
- 神経障害のないCMV感染症患者でIgM型GM2抗体の上昇あり。
- 時間的推移
-
血清糖脂質抗体の抗体価は経時的に低下する。
IgG型GM1抗体の陰性化率は、1か月以内で33%・6か月以内で83%。
半年以内に陰性化した症例の陰性化時期は52.4±46.2日。
- 予後との関連
-
発症時のIgG・IgM型GM1抗体力価が高いこと、IgG型GM1抗体力価が持続的に高いことは、転帰不良(10m独歩不可)と関連する。
人工呼吸器装着群は非装着群と比べて、IgG型GQ1b抗体の陽性率が高い(27% vs 8%)。
GD1a/GD1b複合体・GD1b/GT1b複合体に対するIgG抗体の存在と、重症化・人工呼吸器装着の間に有意な関連性あり。
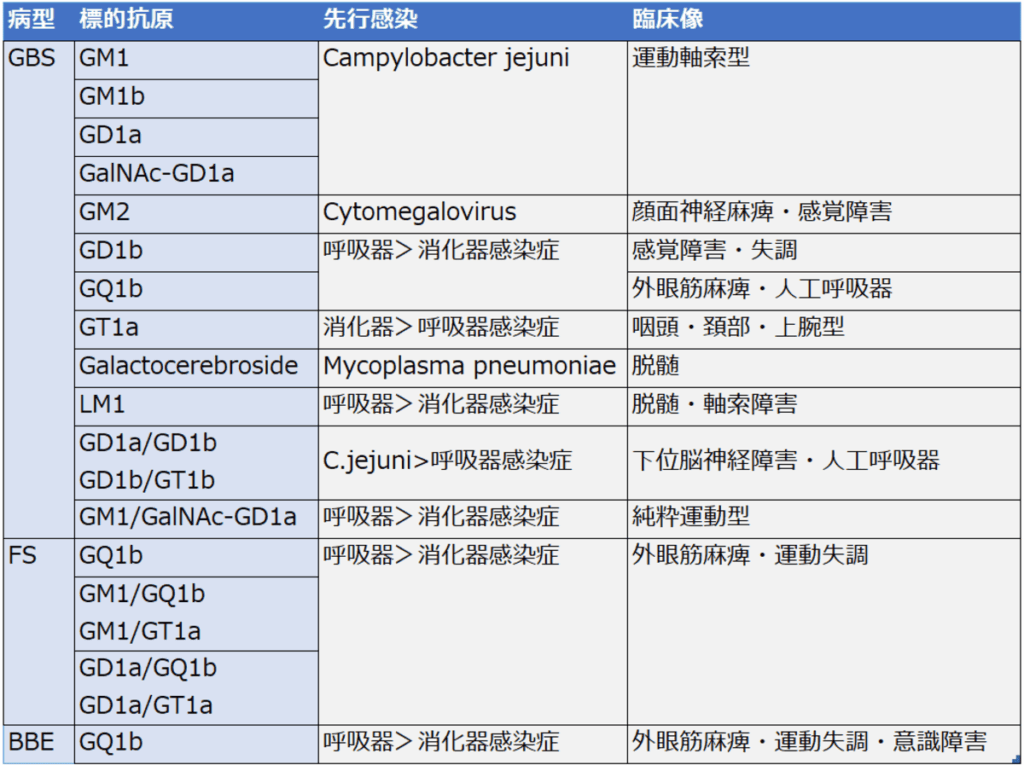
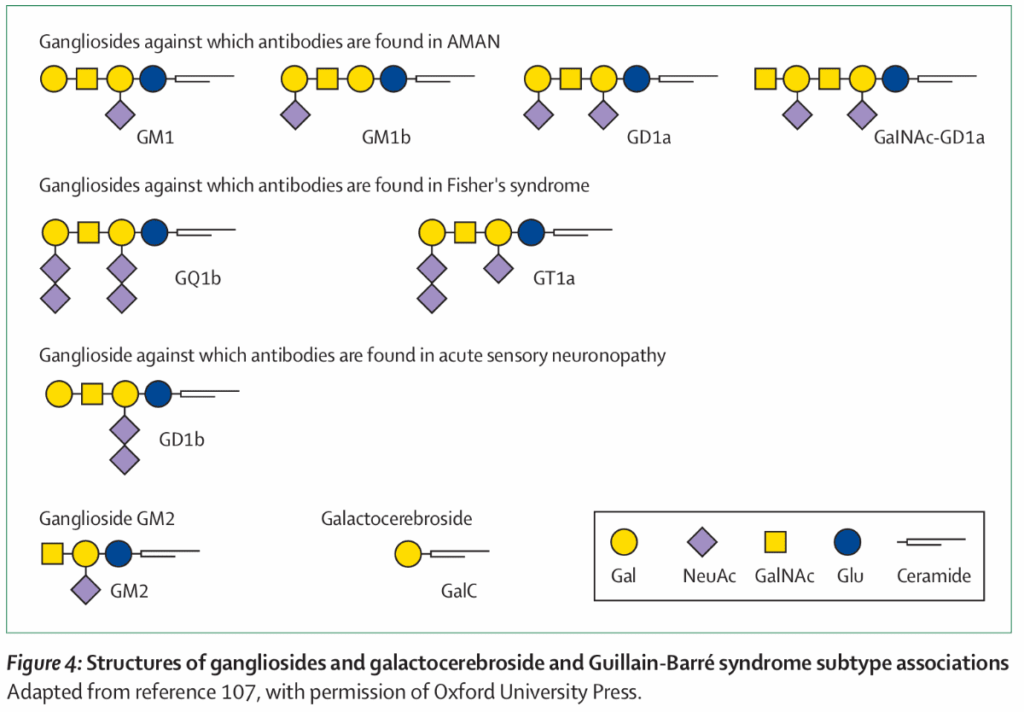
MRI
Gd造影MRI:脊髄神経根・馬尾の造影増強効果。検出感度は83%との報告あり。(*Neurology. 1996;47(3):813-7.)
診断基準
European Academy of Neurology/Peripheral Nerve Society(EAN-PNS)2023
- 必須所見
-
- 上肢と下肢の進行性の筋力低下
- 罹患肢の腱反射減弱・消失
- 病状進行期が4週間以内
- 診断を支持する臨床所見
-
- 比較的対称的である
- 感覚症候が比較的軽度またはみられない
- 脳神経障害(特に両側顔面神経麻痺)
- 自律神経障害
- 呼吸障害(筋力低下による)
- 疼痛(背部・四肢の筋痛・神経根痛)
- (6週間以内の)先行感染
- 診断を支持する検査所見
-
- 脳脊髄液:蛋白上昇(蛋白正常は診断の除外には有用でない)・白血球は<5/μL
- 血液:MFSでは抗GQ1b抗体が陽性となる
- 神経伝導検査:polyneuropathyの所見を呈するが、病初期には正常であることがある
- 診断を疑う所見
-
- 非対称性の筋力低下(顕著かつ持続的)
- 発症時に重度の呼吸障害がある(四肢筋力低下は軽度)
- 発症時に感覚症候(しばしば異常感覚)が主体で、筋力低下は軽度
- 発症時の発熱
- 感覚レベルに沿った障害、Extensor plantar responses
- 腱反射亢進(病初期の腱反射亢進は除外には有用でない)
- 膀胱直腸障害(GBSを除外するものではない)
- 腹痛・嘔吐
- 眼振
- 意識変容(BBEを除く)
- 一般血液検査での異常
- 脳脊髄液:単核・多核球>50/μL
- 24時間以内の症状完成
- 比較的緩徐に(2-4週間かけて)増悪する軽度の筋力低下
- 4週間を超えて病状が悪化する、または治療関連変動(TRFs)が3回以上(A-CIDPを考慮する)
鑑別疾患
- 中枢神経系
-
- 脳幹・脊髄の炎症性・感染性疾患(急性横断性脊髄炎・NMOSD・MOGAD・サルコイドーシス・Sjogren症候群)
- 悪性腫瘍(髄膜癌腫症・神経リンパ腫症)
- 脳幹・脊髄の圧迫(血腫・膿瘍・椎間板ヘルニア・腫瘍)
- 脳幹梗塞
- 代謝性疾患(亜急性連合性脊髄変性症=ビタミンB12・銅欠乏)
- 脊髄前角細胞
-
- 急性弛緩性脊髄炎(ポリオウイルス・エンテロウイルス・ウェストナイルウイルス・日本脳炎ウイルス・狂犬病・ライム病)
- 神経根
-
- 感染症(CMV・HIV・EBV・VZV・ライム病)
- 髄膜癌腫症
- 末梢神経
-
- CIDP・acute onset CIDP
- 代謝性疾患・電解質異常(低血糖・甲状腺機能低下症・ポルフィリア・銅欠乏)
- ビタミン欠乏(B1・B12)
- 中毒(亜酸化窒素・薬剤・アルコール・ビタミンB6・鉛・タリウム・ヒ素・有機リン・グリコール・メタノール・N-ヘキサン)
- critical illness polyneuropathy
- 神経痛性筋萎縮症
- 血管炎
- 感染症(ジフテリア・HIV・ライム病)
- 神経筋接合部
-
- 重症筋無力症
- Lambert-Eaton筋無力症候群
- 神経毒(ボツリヌス・破傷風・ダニ・ヘビ)
- 有機リン中毒
- 筋
-
- 代謝性疾患・電解質異常(低カリウム血症・周期性四肢麻痺・低マグネシウム血症・低リン血症)
- 炎症性筋疾患
- 横紋筋融解症(スタチン・その他薬剤)
- 薬剤誘発性中毒性ミオパチー(コルヒチン・クロロキン・エメチン)
- ミトコンドリア病
- その他
-
- 解離性障害・機能性疾患
AIDPとA-CIDP(acute onset CIDP)の鑑別
- 経過
-
- AIDP:単相性の経過をとり、2-4週間以内に症状のピークに達する。
- SIDP(subacute inflammatory demyelinating polyneuropathy):4-8週間で症状のピークに達する。
- CIDP:8週間を超えて増悪・再発する。
- その他の鑑別点
-
発症:AIDPは明確、CIDPは不明瞭。
先行感染:AIDPは特定されることが多い(約70%)、CIDPは少ない(<30%)。
よりCIDPを疑う臨床経過。
- 再発・増悪が3回以上。
- 独歩可能な程度に症状が軽度。
- 脳神経障害や呼吸障害がない。
参考・引用文献
Lancet. 2021;397(10280):1214-1228.
Lancet. 2016;388(10045):717-27.
N Engl J Med. 2012;366(24):2294-304.
Nat Rev Neurol. 2019;15(11):671-683.
Brain. 2018;141(10):2866-2877.
Brain. 2014;137(Pt 1):33-43.
J Neurol Neurosurg Psychiatry. 1988;51(5):605-12.
Eur J Neurol. 2023;30(12):3646-3674.
日本神経学会, ギラン・バレー症候群,フィッシャー症候群診療ガイドライン2024