神経内科領域では、若年性の不随意運動・パーキンソニズムなどの症候に対して鑑別対象となります。頻度は少ないですが、比較的容易にスクリーニングが可能かつ治療方法があるため、積極的に疑うことが重要と考えます。
診断・治療については別記事にまとめました。
概説
常染色体潜性遺伝形式をとる先天性銅代謝異常症の代表的疾患。細胞内銅輸送蛋白の遺伝子異常により、肝から胆汁中への銅排泄とセルロプラスミンの合成がいずれも障害される。肝臓・脳・角膜などを含む全身臓器に銅が過剰に蓄積し、それらの臓器障害をきたすことで、様々な症状が出現する。病状は進行性であり、無治療で放置されると肝障害・神経障害によって致命的となる予後不良な疾患である。有効な治療方法があり、早期診断・治療によって病状の発症・進行予防が可能である。
病態
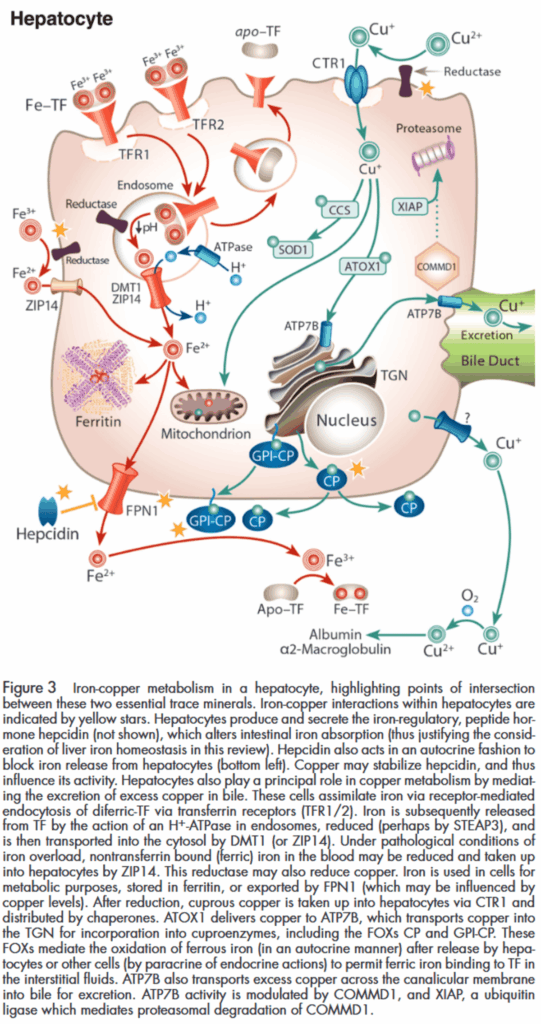
銅代謝についての詳細は、銅・Cu参照。
*Wilson病診療ガイドライン2015.
*Compr Physiol. 2018;8(4):1433-1461.
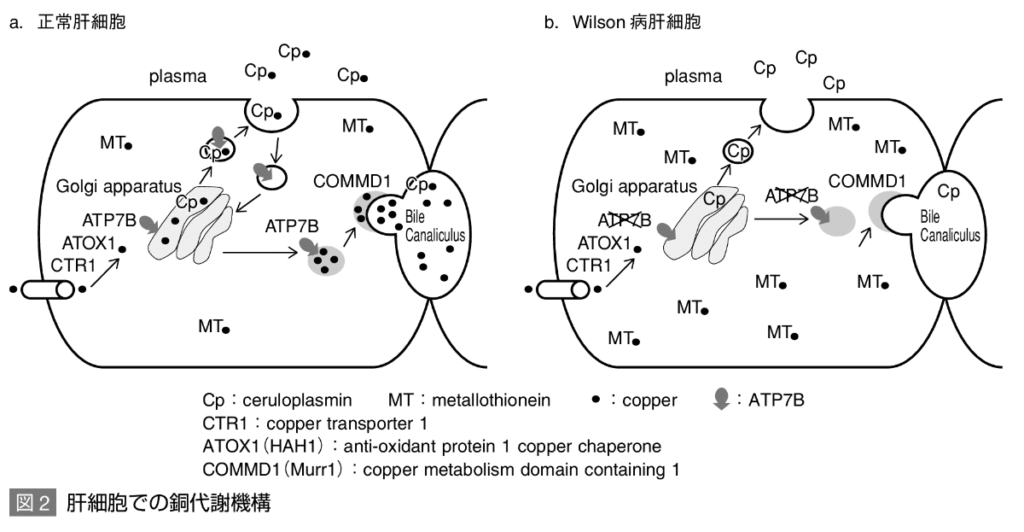
正常肝細胞での銅代謝機構
細胞膜にあるCTR1により、血液中の銅は肝細胞のサイトソルに取り込まれる。
その銅はトランスゴルジ体へ輸送され、ゴルジ体膜に存在するATP7Bによりゴルジ体内に取り込まれる。
ゴルジ体内に取り込まれた銅は、アポセルロプラスミンと結合してホロセルロプラスミンとなって血液中に分泌される。
胆汁への銅分泌はCOMMD1とATP7Bが相互に関与して行っている。
WDでの銅代謝
WDでは13番染色体長腕(13q14.3)に存在するATP7B遺伝子の異常によりATP7Bが正常に機能しない。
肝細胞ではサイトソルからゴルジ体内へ銅が輸送されず、サイトソルに銅が蓄積する。
同時にゴルジ体内は銅欠乏になっているため、アポセルロプラスミンに銅が結合されず、ホロセルロプラスミンの合成が障害される。アポセルロプラスミンはそのまま血液中へ分泌されるが、極めて不安定である。その結果、血清セルロプラスミン・血清銅は低値となる。
一方、肝細胞に蓄積した銅はオーバーフローして血液中に分泌され、アルブミンやアミノ酸と結合して遊離銅となるため、血清中の遊離銅は増加しており、様々な臓器での銅蓄積や尿中銅排泄増加の要因となる。
肝臓に蓄積した銅は、まずメタロチオネインに結合する。メタロチオネインに結合した銅は毒性を持たないが、メタロチオネイン結合容量以上に増加した銅は、酸化ストレス状態を亢進させ、細胞障害をきたす。同時に抗アポトーシス蛋白であるX-linked inhibitor of apoptosis(XIAP)の活性を阻害し、アポトーシスにより細胞死が起こる。さらに酸化ストレスでミトコンドリアやリソソームも障害される。
疫学
発症頻度は約3-4万人に1人。保因者は約100-120人に1人。
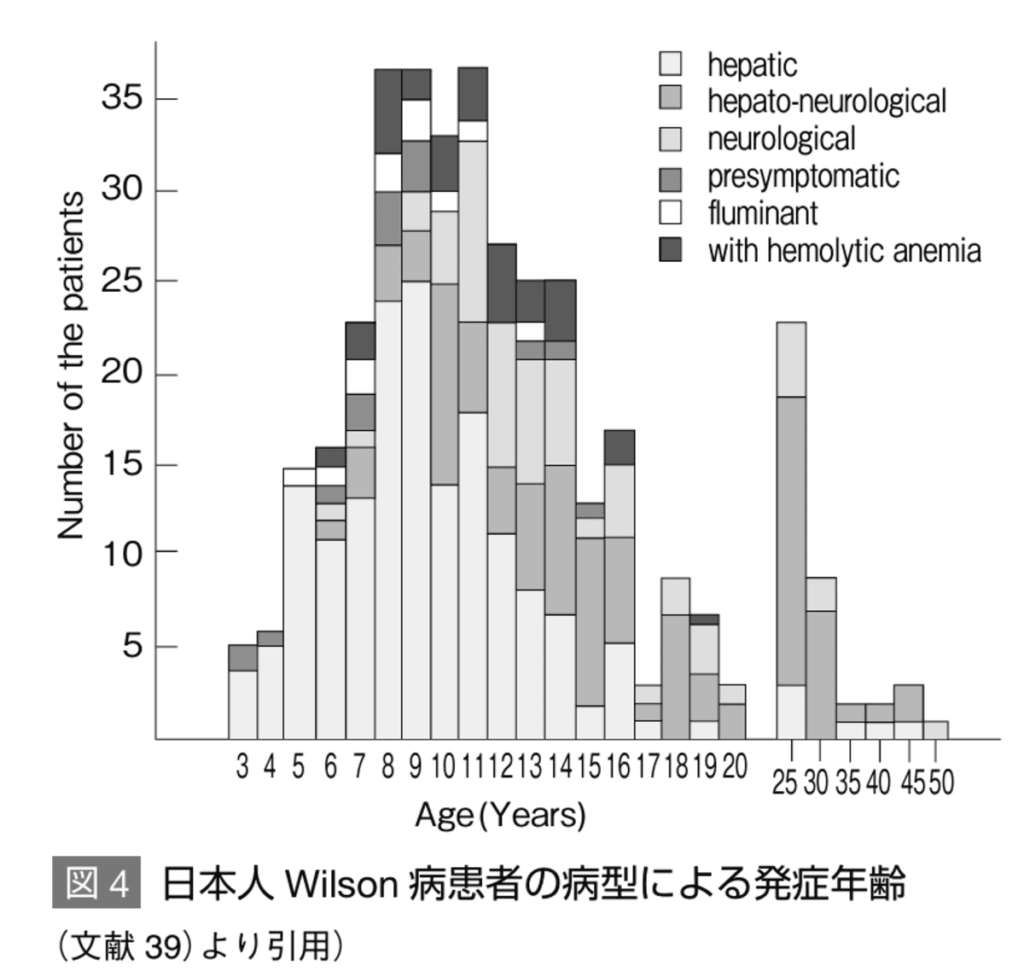
小児発症の患者は肝型が多い。
*Wilson病診療ガイドライン2015.
病型・臨床症状

*J Hepatol. 2025:S0168-8278(24)02706-5.
肝型
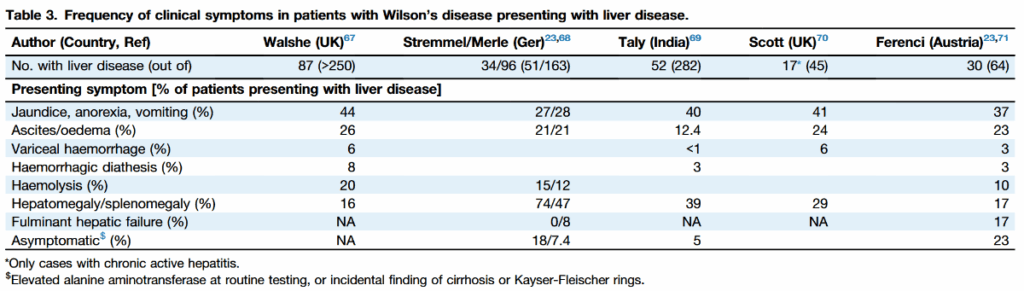
*J Hepatol. 2025:S0168-8278(24)02706-5.
- 疫学
-
肝機能異常で偶発的に見つかる例と、急性肝不全・溶血発作で見つかる例がある。
発症年齢の大多数は5-35歳であり、肝硬変を起こしていた最も若い患者は3歳と報告あり。
約3%の患者は40歳を超えて発症し、肝型も神経型もとりうる。
- 臨床症状
-
慢性肝炎・肝硬変型
- 潜行性に肝硬変へと進展している可能性がある。WDの診断時に35-45%が肝硬変に陥っていると推定されている。
- 症状は、食欲不振・嘔吐・黄疸・腹水・浮腫・消化管出血・出血傾向・肝脾腫・全身倦怠感。
- 重篤な肝障害があっても神経症状を伴わないことがある。
-
急性肝不全型
- 初診時にはトランスアミナーゼ上昇は中等度(ASTは100-500IU/L程度、AST>ALT)
- 血清セルロプラスミンは低値、血清銅と尿中銅排泄は著明に上昇
- 急性血管内溶血を伴うCooms試験陰性の溶血性貧血
- 経静脈的ビタミンK投与に反応しない凝固機能障害
- 急性に進行する腎不全
- ALPは正常~軽度上昇(<400IU/L)
- 血清尿酸値の低下
- Kayser-Fleisher輪(陽性率は50%程度)
- 男女比は1:2と女性に多い
-
溶血性貧血型
- Cooms試験陰性の溶血性貧血は初期症状となりうる。しかし、一般的に著明な溶血は重度の肝障害を伴う。
- 肝細胞の崩壊により肝臓に蓄積した銅が大量に放出され、溶血をさらに悪化させる。
- 溶血発作の間、尿中銅排泄や血清遊離銅(セルロプラスミン非結合型)は著明に上昇する。
- 腎臓ではアミノ酸・ブドウ糖・尿酸の輸送異常を伴って、Fanconi症候群や進行性腎不全を生じる可能性がある。
自己免疫性肝炎と紛らわしい例
- 10-30歳の患者で、黄疸・トランスアミナーゼ上昇・高γグロブリン血症を伴うものは、非特異的に自己抗体の上昇を伴うことがある。
- WDと自己免疫性肝炎の病像が一致することがある。
神経型
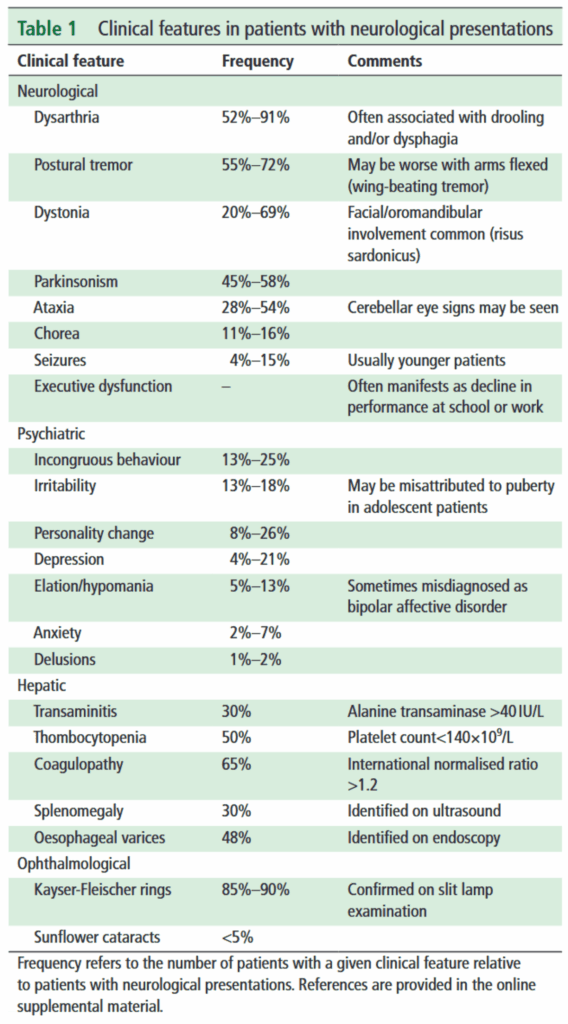
*J Neurol Neurosurg Psychiatry. 2021;92(10):1053-1061.
- 神経症状
-
- 発症年齢は6-40歳と幅広いが、多くは15-20歳頃である。
- 初発症状で多いのは、言語障害・不随意運動・書字拙劣である。
- 言語障害:発語が緩徐かつ不明瞭となる。音程が単調である。鼻声のこともある。会話中に流涎を伴いやすい。
- 不随意運動:動作時・姿勢時の振戦が多い。書字に際して強調される傾向がある。上肢のアテトーゼや舞踏病様運動で発症することがある。
- 進行例で出現する症状として、姿勢運動障害がある。以下代表例。
- 歩行開始時に上肢がゆっくり挙上し、続いて後方へ伸展回内する(dystonic posture)
- 上肢の回内回外時に首を瞬間的に振る
- 動作中に急に下肢屈曲や上肢の後方伸展が起こり、その位置でしばらく強直状態になる(choreoathetosis)
- 姿勢保持障害として易転倒性がみられる。
- 高度な腰椎後弯によりお腹を突き出し、口を半開きにして両腕をゆっくり振り、下肢を引きずりながら歩く姿勢は本疾患に特徴的。
- 精神症状
-
- 頻度が高いのは、集中力低下・注意力減弱・突然の気分変調などによる学業成績低下。
- 病初期には気分が多幸的となる。
- 症状が顕著になると性格・人格変化に至る。
- 態度が乱暴となり、嘘偽り・詐欺行為などの反社会的行動を繰り返すこともある。
- 錐体外路障害による表情の乏しさ・仮面用顔貌からうつ病、異常な言動から統合失調症などと診断されやすい。
発症前型
家族内検索・偶然の血液検査や眼科検診を契機として診断に至ったが、症状がまだ出現していない患者のこと。家族内にWDと診断された患者がいて、その後の家族内検索で診断に至る例が大部分を占める。WDは無治療であれば必ず発症し予後不良な疾患であるが、早期診断すれば後遺症なく治療可能な疾患でもあるため、発症前型を的確に診断し早期治療介入することが重要である。
その他の症状
腎症状:血尿・蛋白尿の頻度は高い。腎尿細管障害→Caの尿中排泄増加→腎結石。
骨・関節症状:関節内への銅沈着が原因。
内分泌症状:副甲状腺機能低下・インスリノーマや肝硬変による低血糖・乳漏症を伴う月経不順・不妊や繰り返す流産
心筋症:心筋肥大・不整脈・冠動脈硬化
眼症状:Kayser-Fleisher輪・ひまわり白内障
皮膚症状:皮膚乾燥・毛根性角化症・クモ様血管腫・口唇炎
検査
生化学検査

*J Hepatol. 2025:S0168-8278(24)02706-5.
- 血清セルロプラスミン
-
セルロプラスミンは血中の主要な銅の輸送蛋白であり、フェロキシダーゼ活性を有する急性期蛋白である。血清セルロプラスミンは1分子あたり6つの銅原子を含有するホロセルロプラスミンが大部分であるが、アポセルロプラスミンもごくわずかに存在する。健常人では血中銅の約90%はセルロプラスミンと結合している。
血清セルロプラスミンはWDでは低下しており、診断に有用である。
しかし、ネフローゼ症候群・蛋白漏出性胃腸症など蛋白喪失が高度な場合、蛋白合成が高度に低下した肝不全例などでは、血清セルロプラスミンは低値となる。一方、急性炎症や妊娠・エストロゲン投与中など高エストロゲン状態では、血清セルロプラスミンは上昇する。
- 血清銅
-
銅は血中ではセルロプラスミンと結合した状態および結合していない遊離銅として存在し、血中銅はそれらを合わせた値として測定される。
セルロプラスミン1mgには銅3.15μgが結合しているため、血中遊離銅(μg/dL)は血中銅(μg/dL)-3.15×セルロプラスミン(mg/dL)で計算できる。
WDでは通常、セルロプラスミンと血中銅が低下しているが、血中遊離銅は上昇している。しかし急性肝不全など高度の肝細胞障害を示すWDでは、肝細胞からの急激な流出により血中銅は上昇する。血中遊離銅は健常者では10-15μg/dL以下であるのに対して、未治療WDでは20-25μg/dL以上である。
血中遊離銅は急性肝不全や慢性胆汁うっ滞でも上昇する。
- 尿中銅
-
24時間尿中銅は血中のセルロプラスミン非結合銅を反映する。
随時尿での測定は変動が大きく診断に適切ではない。腎不全患者には検査を適用できない。
未治療・症候性WD患者における24時間尿中銅は、通常100μg以上である。小児や未発症のWDなど、16-23%のWDでは100μg未満との報告あり。
健常人での24時間尿中銅は通常40μg未満である。しかし活動性の高い肝障害では100μg以上に増加することがある。保因者では健常人より増加することが多いが、40μgを超えることは少ない。
24時間尿中銅の測定における問題は、正確な蓄尿と蓄尿容器への銅のコンタミネーションである。ディスポの蓄尿容器を使用するとコンタミネーションのリスクは少なくなる。
- ペニシラミン負荷試験
-
検査開始時にペニシラミン500mgを服用して蓄尿を開始し、12時間後にも再度ペニシラミン500mgを服用して、24時間蓄尿して尿中銅を測定する。
WD患者では通常1,600μg/24時間以上であり、肝機能異常を示すWDと他の肝疾患の鑑別に有用である。
- 肝組織内銅含有量
-
WDの最も有用な生化学的診断法。
肝組織内銅含有量が
- 250μg/g乾重量以上であればWDである可能性が極めて高い。
- 70-95μg/g乾重量とすれば軽度特異度が低下、感度が大きく上昇。
- 健常者では50μg/g乾重量を超えることはほとんどない。
- 尿酸
-
症候性WDでは、尿細管障害を反映して通常低下している。
Kayser-Fleisher輪
角膜の周辺(Descemet膜)がきつね色(golden-brown)・黄緑色(yellow-green)・青銅色(bronze)などに変化する。
硫黄銅の蓄積による変化と考えられている。
スリットランプで検出されるが、強い所見があれば肉眼でも見ることができる。
神経型の90-100%にみられる一方、肝型では50%程度にみられるとの報告あり。
疾患の治療によって、色素の程度は減少・消失することが多い。
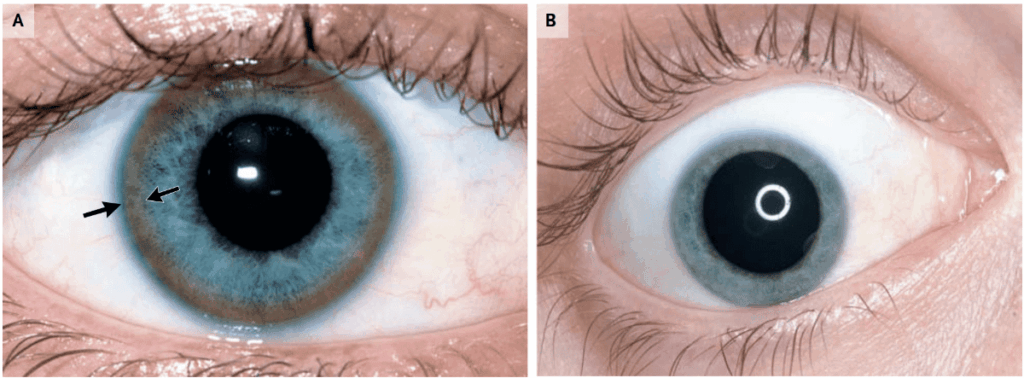
A:矢印がKayser-Fleisher輪。B:5年間の治療後に消失。
*N Engl J Med. 2012;366(12):e18.
神経画像
- CT
-
被殻・尾状核・淡蒼球・視床の低吸収域
大脳~脳幹の脳室拡大を伴う脳萎縮
進行例では大脳白質・小脳の低吸収域
- MRI
-
大脳基底核・視床・大脳白質に左右対称性の信号強度異常がみられる。病理学的には壊死・浮腫・海綿状変性である。被殻・淡蒼球・尾状核に変化が強く、T2WIにおいて鉄・銅の沈着による低信号と変性などによる高信号が混在する。T2*WI・SWIでは低信号を呈する。
赤核・黒質網様体外側部・上丘を除く中脳にT2WIで高信号病変あり(face of the giant panda sign)。
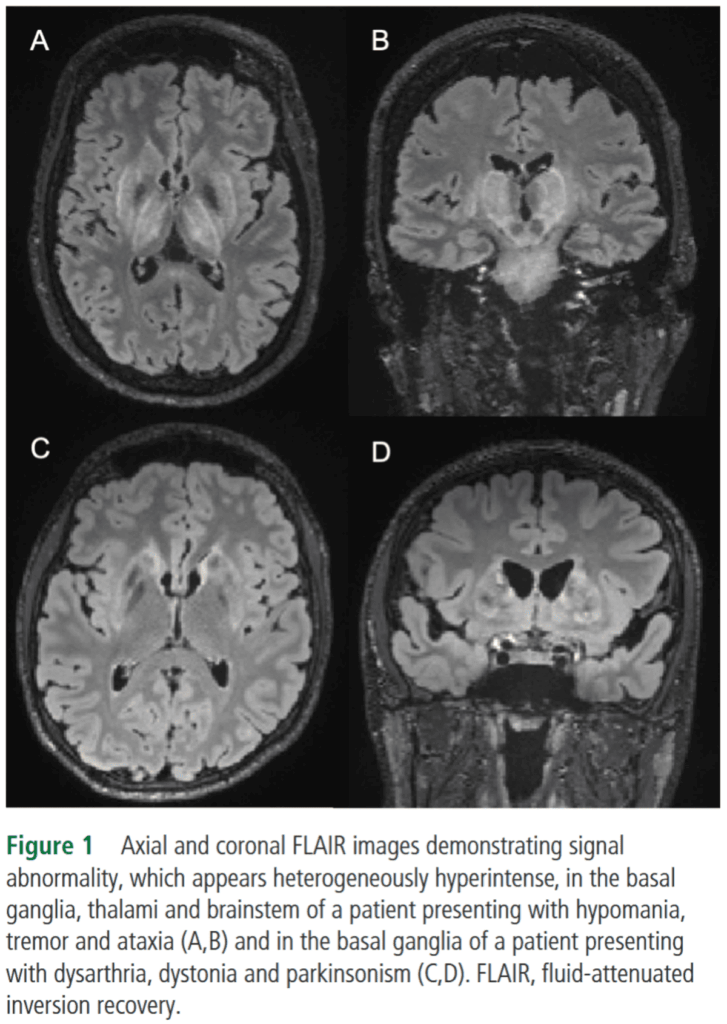
*J Neurol Neurosurg Psychiatry. 2021;92(10):1053-1061.
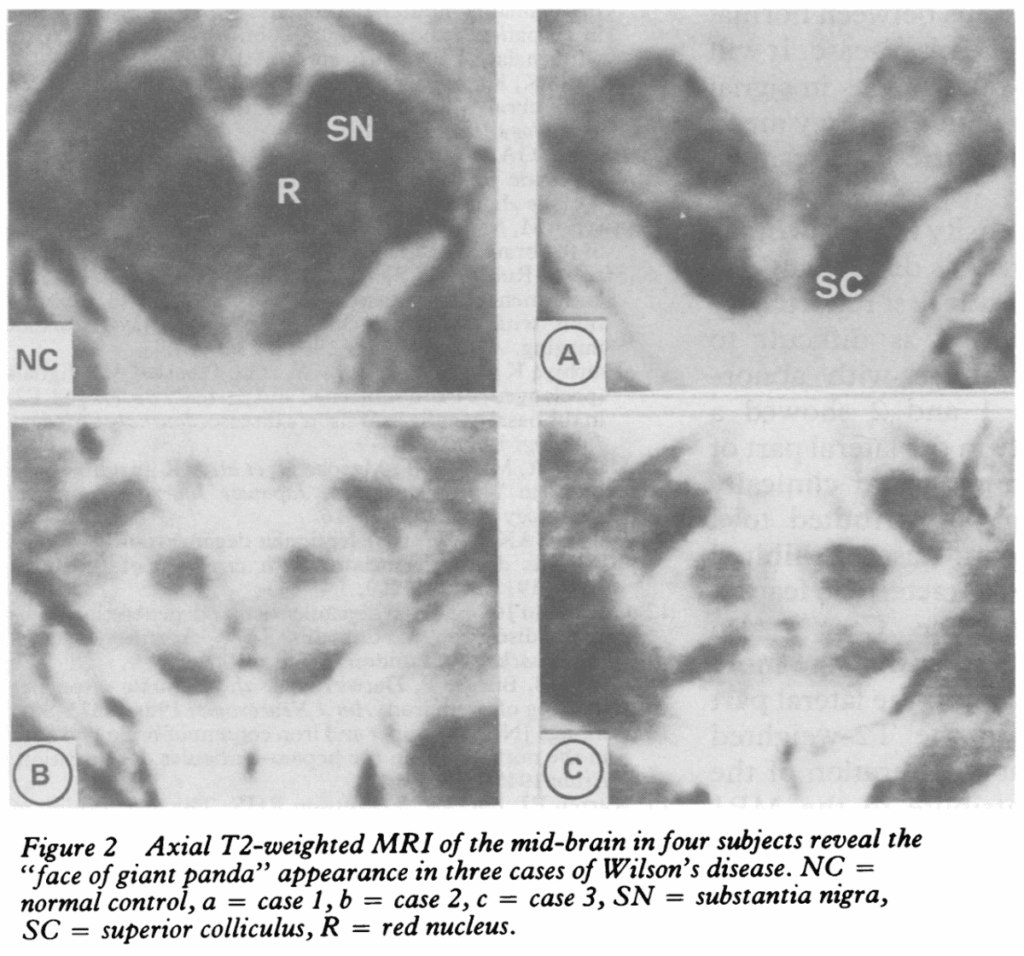
face of the giant panda sign
*J Neurol Neurosurg Psychiatry. 1991;54(7):624-6.
腹部画像
初期には脂肪肝、進行すると慢性肝炎様、さらに進行すると肝硬変となり、肝細胞癌を併発することもある。
WDに特異的な腹部画像はなく、病状に応じた画像変化を呈する。
遺伝子検査
ATP7Bは染色体13q14.3に存在する。
ATP7Bに2つの変異が同定されれば、WDと診断できる。
変異は患者によって様々で、500以上の変異が報告されている。日本では2333G>T(R778L)変異が最も多く(20-25%)、次いで2874delC(frame shift, N958TfsX35)(20%)、1708-5T>G(splice, exon 5 skipping)、2621C>T(A874V)、3809A>G(N1270S)が多い。
病理検査
肝の組織所見は多彩であり、特異的な所見はない。
脂肪変性とウイルス性肝炎・肝硬変に類似した病変の併存がみられる。
銅の組織化学的染色では、銅蓄積の状態を正確に評価できない。
参考・引用文献
J Hepatol. 2025:S0168-8278(24)02706-5.
Hepatology. 2023;77(4):1428-1455.
J Neurol Neurosurg Psychiatry. 2021;92(10):1053-1061.
Wilson病診療ガイドライン2015